HUKUM
II TERMODINAMIKA
Formulasi
Kelvin-Planck atau hukum
termodinamika kedua menyebutkan bahwa adalah tidak mungkin untuk membuat
sebuah mesin kalor yang bekerja
dalam suatu siklus yang semata-mata mengubah energi panas yang diperoleh dari
suatu reservoir pada suhu
tertentu seluruhnya menjadi usaha mekanik. Hukum kedua termodinamika mengatakan
bahwa aliran kalor memiliki arah; dengan kata lain, tidak semua proses di alam
semesta adalah reversible (dapat dibalikkan arahnya). Sebagai
contoh jika seekor beruang
kutub tertidur di atas salju, maka salju dibawah tubuh nya akan
mencair karena kalor dari tubuh beruang tersebut. Akan
tetapi beruang tersebut tidak dapat mengambil kalor dari salju tersebut untuk
menghangatkan tubuhnya. Dengan demikian, aliran energi kalor memiliki arah,
yaitu dari panas ke dingin. Satu aplikasi penting dari hukum kedua adalah studi
tentang mesin kalor.
Hukum II
Termodinamika
Hukum II
Termodinamika, yang dianggap sebagai salah satu hukum dasar ilmu fisika, menyatakan bahwa pada kondisi normal
semua sistem yangdibiarkan tanpa
gangguan cenderung menjadi tak teratur, terurai, dan rusak sejalan
dengan waktu. Seluruh benda, hidup atau mati, akan aus, rusak, lapuk,terurai, dan hancur. Akhir seperti ini mutlak akan
dihadapi semua makhluk dengan caranya
masing-masing dan menurut hukum ini, proses yang tak terelakkan ini tidak dapat dibalikkan.Kita
semua mengamati hal ini. Sebagai contoh, jika Anda meninggalkansebuah mobil di
padang pasir, Anda tidak akan menemukannya dalam keadaanlebih baik ketika Anda menengoknya beberapa tahun kemudian. Sebaliknya,Anda
akan melihat bannya kempes, kaca jendelanya pecah, sasisnya berkarat,dan mesinnya rusak. Proses yang sama tak
terhindarkan berlaku pula padamakhluk
hidup, bahkan lebih cepat.
Hukum II Termodinamika adalah cara mendefinisikan proses alam inidengan
persamaan dan perhitungan fisika.Hukum fisika yang terkenal ini
disebut juga “Hukum Entropi”. Entropiadalah selang ketidakteraturan yang terjadi dalam
suatu sistem. Entropi sistemmeningkat ketika
sistem itu bergerak dari keadaan teratur, terorganisir, danterencana menuju keadaan yang lebih tidak
teratur, tersebar dan tidak terencana.Semakin
tidak teratur suatu sistem, semakin tinggi pula entropinya.
Hukum Entropi menyatakan bahwa seluruh alam semesta bergerak menujukeadaanyang semakin tidak teratur, tidak terencana, dan tidak terorganisir.Keabsahan Hukum II Termodinamika atau Hukum Entropi ini telahterbukti, baik secara eksperimen maupun teoretis. Para ilmuwan terpenting dimasa kita menyetujui fakta bahwa Hukum Entropi akan menjadi paradigmayang mendominir hingga periode sejarah mendatang. Albert Einstein, ilmuwanterbesar di masa kita ini mengakuinya sebagai “hukum utama dari semua sains”.Rir Arthur Eddington juga menyebutnya sebagai “hukum metafisika tertinggi diseluruh jagat”.Teori evolusi adalah klaim yang diajukan dengan sepenuhnyamengabaikan hukum fisika yang mendasar dan memiliki kebenaran universalini. Mekanisme yang diajukan evolusi benar-benar bertentangan dengan hukumini. Teori evolusi menyatakan bahwa atom-atom dan molekul-molekul yangtidak hidup, tidak teratur dan tersebar, sejalan dengan waktu menyatu secaraspontan dalam urutan dan perencanaan tertentu membentuk molekul-molekulyang luar biasa kompleks seperti protein, DNA dan RNA. Kemudian merekalambat laun menghasilkan jutaan spesies makhluk hidup yang berbeda, bahkandengan struktur yang lebih kompleks lagi. Menurut teori evolusi, proses yang diperkirakan ini – yang menghasilkan struktur yang lebih terencana, lebihteratur, lebih kompleks dan lebih terorganisir – terbentuk dengan sendirinya pada tiap tahapan dalam kondisi alamiah. Hukum Entropi menegaskan bahwaapa yang disebut proses alamiah ini jelas bertentangan dengan hukum-hukumfisika .Ilmuwan evolusionis juga menyadari fakta ini. J. H. Rush menyatakan:Dalam perjalanan evolusinya yang kompleks, kehidupan menunjukkan perbedaan yang sangat besar dibandingkan kecenderungan yang dinyatakanHukum II Termodinamika. Sementara Hukum II menyatakan pergerakanirreversibel ke arah entropi yang lebih tinggi dan tak teratur, kehidupan terus berevolusi ke tingkat keteraturan yang lebih tinggi.
Hukum Entropi menyatakan bahwa seluruh alam semesta bergerak menujukeadaanyang semakin tidak teratur, tidak terencana, dan tidak terorganisir.Keabsahan Hukum II Termodinamika atau Hukum Entropi ini telahterbukti, baik secara eksperimen maupun teoretis. Para ilmuwan terpenting dimasa kita menyetujui fakta bahwa Hukum Entropi akan menjadi paradigmayang mendominir hingga periode sejarah mendatang. Albert Einstein, ilmuwanterbesar di masa kita ini mengakuinya sebagai “hukum utama dari semua sains”.Rir Arthur Eddington juga menyebutnya sebagai “hukum metafisika tertinggi diseluruh jagat”.Teori evolusi adalah klaim yang diajukan dengan sepenuhnyamengabaikan hukum fisika yang mendasar dan memiliki kebenaran universalini. Mekanisme yang diajukan evolusi benar-benar bertentangan dengan hukumini. Teori evolusi menyatakan bahwa atom-atom dan molekul-molekul yangtidak hidup, tidak teratur dan tersebar, sejalan dengan waktu menyatu secaraspontan dalam urutan dan perencanaan tertentu membentuk molekul-molekulyang luar biasa kompleks seperti protein, DNA dan RNA. Kemudian merekalambat laun menghasilkan jutaan spesies makhluk hidup yang berbeda, bahkandengan struktur yang lebih kompleks lagi. Menurut teori evolusi, proses yang diperkirakan ini – yang menghasilkan struktur yang lebih terencana, lebihteratur, lebih kompleks dan lebih terorganisir – terbentuk dengan sendirinya pada tiap tahapan dalam kondisi alamiah. Hukum Entropi menegaskan bahwaapa yang disebut proses alamiah ini jelas bertentangan dengan hukum-hukumfisika .Ilmuwan evolusionis juga menyadari fakta ini. J. H. Rush menyatakan:Dalam perjalanan evolusinya yang kompleks, kehidupan menunjukkan perbedaan yang sangat besar dibandingkan kecenderungan yang dinyatakanHukum II Termodinamika. Sementara Hukum II menyatakan pergerakanirreversibel ke arah entropi yang lebih tinggi dan tak teratur, kehidupan terus berevolusi ke tingkat keteraturan yang lebih tinggi.
Dalam
sebuah artikel di majalah Science, ilmuwan evolusionis, Roger Lewin, menyatakan kebuntuan evolusi secara
termodinamika:
Satu masalah yang
dihadapi para ahli biologi adalah pertentangan nyataoleh evolusi terhadap Hukum II Termodinamika. Semua sistem seharusnyarusak sejalan dengan waktu, semakin tidak
teratur, bukan sebaliknya.
Ilmuwan evolusionis lainnya, George Stravropoulos,
menyatakankemustahilan termodinamis dari pembentukan kehidupan secara
spontan danketidaklayakan penjelasan adanya mekanisme-mekanisme makhluk hidup
yangkompleks melalui hukum-hukum alam. Ini
dinyatakannya dalam majalahevolusionis
terkenal, American Scientist: Namun
sesuai dengan Hukum Termodinamika II, dalam kondisi biasathdak ada molekul
organik kompleks dapat terbentuk secara spontan, tetapisebaliknya akan
hancur. Memang, semakin kompleks sebuah molekul, semakintidak stabil keadaannya
dan semakin pasti kehancurannya, cepat atau lambat.Kendatipun melalui pembahasaan yang membingungkan atau sengaja dibuatmembingungkan,
fotosintesis dan semua proses kehidupan, serta kehidupan itusendiri, tidak dapat dipahami berdasarkan ilmu
termodinamika ataupun ilmu pasti
lainnya
Dan selain itu
pernyataan kami Rezky Bintang dan Michael tentang Hukum II Termodinamika, Katanya stok minyak bumi dalam perut bumi
sekarang tinggal sedikit, karenanya kita diminta untuk menghemat energi. Aneh
ya… Menurut hukum pertama termodinamika, dalam suatu sistem tertutup (alam
semesta kita termasuk sistem tertutup), jumlah energi total selalu kekal.
Energi dapat berubah bentuk dan berpindah dari satu benda ke benda yang lain,
tetapi jumlah energi total selalu tetap.
Kalau energi selalu kekal, mengapa kita harus menghemat energi ?
Benar
bahwa hukum pertama termodinamika mengatakan kepada kita bahwa energi selalu
kekal. Walaupun demikian, hukum pertama termodinamika tidak menjelaskan kepada
kita bahwa ada bentuk energi yang berguna, sedangkan ada bentuk energi yang
tidak berguna… Energi potensial kimia dalam minyak bumi merupakan salah satu
bentuk energi yang berguna. Energi potensial kimia dalam minyak bumi (bensi,
solar, minyak tanah, etc) bisa khta gunakan untuk menggerakkan kendaraan,
memasak makanan atau bisa juga digunakan untuk membangkitkan listrik. Energi
potensial gravitasi air di waduk bisa kita gunakan untuk membangkitkan listrik.
Energi panas bumi juga bisa kita gunakan untuk membangkitkan listrik. Energi
kinetik angin, energi panas matahari, energi nuklir dkk… Mengenai sumber
energi akan dibahas dalam episode berikutnya…
Ketika
energi yang berguna tersebut kita manfaatkan, akan terjadi perubahan bentuk
energi. Jika digunakan untuk menggerakkan kendaraan, energi potensial kimia
dalam minyak bumi akan berubah bentuk menjadi energi kinetik kendaraan + kalor
alias panas (panas timbul akibat adanya gesekan). Jika digunakan untuk
membangkitkan listrik, energi potensial gravitasi pada air di waduk akan
berubah bentuk menjadi energi kinetik rotasi turbin. Energi kinetik rotasi
turbin akan berubah bentuk menjadi energi listrik. Energi listrik akan berubah
bentuk menjadi energi kinetik rotasi (kipas angin), energi cahaya
(lampu), kalor alias panas (setrika listrik) dkk… Energi kinetik rotasi kipas
akan berubah bentuk menjadi energi dalam udara + kalor alias panas (panas timbul
akibat adanya gesekan pada kipas). Energi potensial gravitasi pada buah mangga
akan berubah bentuk menjadi energi kinetik translasi apabila buah mangga
tersebut jatuh ke tanah. Ketika mencium tanah, energi kinetik translasi buah
mangga akan berubah bentuk menjadi energi dalam buah mangga tersebut + energi
dalam tanah. Dari beberapa contoh perubahan bentuk energi ini, tampak bahwa
hukum pertama termodinamika baik adanya… Btw, sangat banyak proses di alam
semesta yang kita harapkan dapat mengubah bentuk energi tetapi kenyataannya
tidak pernah terjadi… Apakah dirimu pernah melihat yang sebaliknya – buah
mangga yang sedang diam di tanah tiba-tiba bergerak ke atas karena energi dalam
berubah bentuk menjadi energi kinetik ? Seandainya energi dalam berubah menjadi
energi kinetik sehingga buah mangga meluncur ke atas, hukum pertama
termodinamika tidak pernah dilanggar. Energi akan selalu kekal dalam proses
tersebut… tapi kenyataanya buah mangga tidak pernah meluncur ke atas dengan
sendirinya…
Semua
proses yang terjadi secara alami hanya berlangsung pada satu arah saja tapi
tidak dapat berlangsung pada arah sebaliknya (biasa disebut sebagai proses
ireversibel alias tidak dapat balik). Setelah terlepas dari tangkainya dan
jatuh bebas hingga mencium tanah, buah mangga tidak pernah meluncur ke atas
lagi. Buku yang kita dorong lalu berhenti tidak pernah bergerak kembali ke arah
kita. Kalau kita menyentuhkan benda yang bersuhu tinggi (benda panas) dengan
benda yang bersuhu rendah (benda dingin), kalor alias panas dengan sendirinya
mengalir dari benda bersuhu tinggi menuju benda yang bersuhu rendah. Kita tidak
pernah melihat proses sebaliknya, di mana kalor dengan sendirinya berpindah
dari benda dingin menuju benda panas. Jika proses ini terjadi, maka benda yang
dingin akan bertambah dingin, sedangkan benda yang panas akan bertambah panas.
Tapi kenyataannya tidak seperti itu… Terdapat banyak proses ireversibel
yang tampaknya berbeda satu sama lain, tapi semuanya berkaitan dengan perubahan
bentuk energi dan perpindahan energi dari satu benda ke benda lain. Misalnya
ada gempa bumi dasyat sehingga bangunan-bangunan pada roboh (bangunan roboh
akibat adanya energi yang dibawa oleh gelombang gempa). Apakah dirimu pernah
melihat setiap bagian bangunan yang roboh tersebut ngumpul lagi dan berdiri
tegak seperti semula ? Atau misalnya adikmu yang sangat nakal menjatuhkan
sebuah gelas ke lantai hingga pecah… Apakah dirimu pernah melihat
serpihan-serpihan gelas yang tercecer di lantai ngumpul lagi dan membentuk
gelas hingga utuh seperti semula ? Tidak pernah terjadi… masih sangat banyak
contoh lain. Sisanya dipikirkan sendiri ya… Semua proses ireversibel tersebut
kelihatannya sangat sepele sehingga kadang luput dari perhatian kita. Btw,
kesimpulan akhir-nya bikin diriku ketakutan Mengenai hal ini
akan gurumuda bahas pada episode berikutnya (Entropi dan hukum kedua
termodinamika – pernyataan umum). Terlebih dahulu kita kupas tuntas beberapa
pernyataan khusus dari hukum kedua termodinamika…
Untuk
menjelaskan proses termodinamika yang hanya terjadi pada satu arah (proses
ireversibel), para ilmuwan merumuskan hukum kedua termodinamika. Hukum kedua
termodinamika menjelaskan proses apa saja yang bisa terjadi di alam semesta dan
proses apa saja yang tidak bisa terjadi. Salah seorang ilmuwan yang bernama R.
J. E. Clausius (1822-1888) membuat sebuah pernyataan berikut :
Kalor
berpindah dengan sendirinya dari benda bersuhu tinggi ke benda bersuhu rendah;
kalor tidak akan berpindah dengan sendirinya dari benda bersuhu rendah ke benda
bersuhu tinggi (Hukum
kedua termodinamika – pernyataan Clausius).
Pernyataan
eyang butut Clausius merupakan salah satu pernyataan khusus hukum kedua
termodinamika. Disebut pernyataan khusus karena hanya berlaku untuk satu proses
saja (berkaitan dengan perpindahan kalor). Karena pernyataan ini tidak
berkaitan dengan proses lainnya, maka kita membutuhkan pernyataan yang lebih
umum. Perkembangan pernyataan umum hukum kedua termodinamika sebagiannya
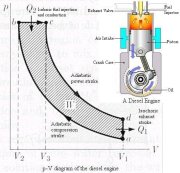
didasarkan pada studi tentang mesin kalor. Karenanya terlebih dahulu kita bahas
mesin kalor…